🔩 イオンの結合と性質
塩化ナトリウムの生成と電子の授受
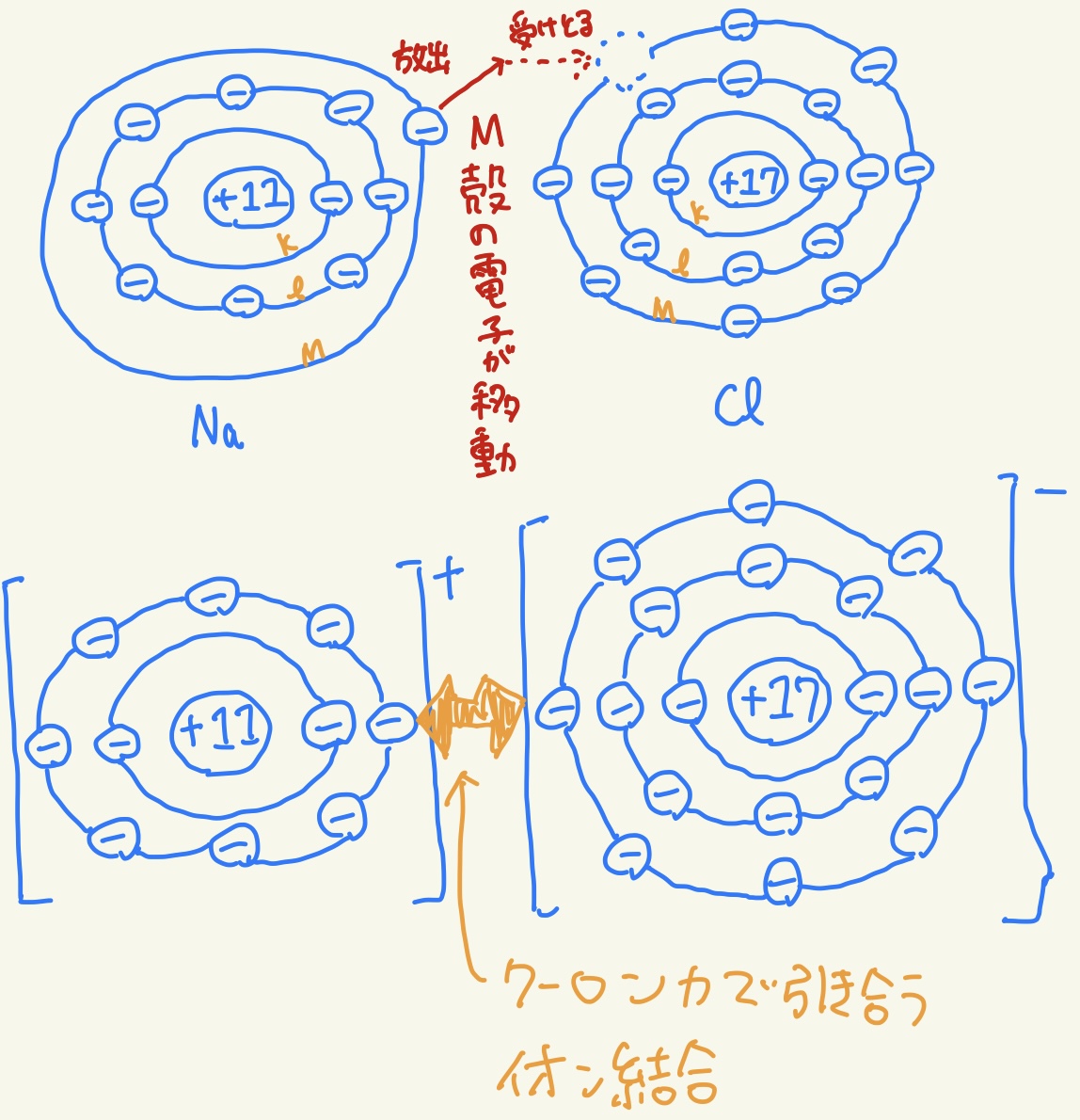
単体の塩素Cl2と単体のナトリウムNaが反応すると、ナトリウムから電子が放出され、塩素はそれを受け取って、ナトリウムイオンNa+ と塩化物イオンCl -とから構成された塩化ナトリウムNaClが生成する。これは、ナトリウムはイオン化エネルギーが小さいので電子を放出して陽イオンになりやすく、 塩素は電子親和力が大きいので電子を受け取って陰イオンになりやすいからである。その結果、ナトリウムはネオンNeと同じ安定な電子配置となり、 塩素はアルゴンArと同じ安定な電子配置となる。
イオン結合の性質
①イオン結合とは、陽イオンと陰イオンとがクーロン力(静電気力)で互いに引き合って結合することをいう。一般に、 陽性の強い元素(金属元素)と陰性の強い元素(非金属元素)とは、イオン結合により結合していて、その結合が強いため融点が高く、イオン結合でできた化合物のほとんどは常温で固体である。
②イオン結合には単原子イオンどうしの結合の他、多原子イオンとの結合も存在する。多原子イオンを構成する原子どうしの結合は、共有結合と呼ばれる結合であるが、その物質全体はイオンからなる物質(または単なるイオン)という。
③イオン結合のもとになるクーロン力には方向性が存在しない(イオンから立体的に全ての方向に均一に力が及ぶ)。常温・常圧環境下では、多数のナトリウムイオンと同数の塩化物イオンが互いに規則的に交わり合い、電気的に中性を保っている。
④クーロンの法則により、イオン結合の強さは、陽イオンと陰イオンの価数が大きいほど強く、異符号のイオン間の距離が小さくなるほど強くなるので、融点も高くなると予想される。例えば、Cl -を共通にして、Na +とK+ とではKClの方がイオン間の距離が大きいため融点が少し低くなっている。Ca2+を共通にしてCl-とO2-とでは、2価のO2-からなるCaOの融点が非常に高くなっている。
下記図・式参照
クーロン力の公式
\[ F = k \frac{q_1 q_2}{r^2} \] F : クーロン力の大きさ
k : 比例定数 \[ k = \frac{1}{4 \pi \varepsilon_0} = 9 \times 10^9 \; [\mathrm{N \cdot m^2 / C^2}] \] \[ \varepsilon_0 = 8.854 \times 10^{-12} \; [\mathrm{F/m}] \quad \text{(真空の誘電率)} \] \( q_1, q_2 \) : 点電荷の電気量 (C)
\( r \) : 2つの点電荷間の距離 (m)
📊 イオン半径と化合物の融点
| 陽イオンの半径 | 陰イオンの半径 | イオン間の距離 | 融点(℃) |
|---|---|---|---|
| Na+:0.116 K+:0.152 | Cl-:0.167 Cl-:0.167 | 0.283 0.319 | NaCl 801 KCl 770 |
| Ca2+:0.114 Ca2+:0.114 | Cl-:0.167 O2-:0.126 | 0.281 0.240 | CaCl2 772 CaO 2572 |
🔩 組成式について
組成式とは
イオンからなる物質や、金属の単体や共有結合の結晶では、構成粒子がはてしなく結合しているため、区切りを決めることができない。したがって、これらの物質を表す化学式は、構成する成分元素の原子の種類と数を最も簡単な整数比で表した組成式 が用いられる。
組成式の書き方と読み方
書き方のルール
- 陽イオン → 陰イオンの順で書く。
例:NaCl(Na+ と Cl−)/MgCl2(Mg2+ と Cl−) - 電荷の総和が 0 になるように個数を決める。
例:Mg2+ と Cl− → Cl− を 2 個で中性 → MgCl2
例:Al3+ と O2− → 最小公倍数 6 でつり合う(Al が 2、O が 3)→ Al2O3 - 最も簡単な整数比(既約比)にする。
例:Ca2+ と PO43− → 3:2 で中性 → Ca3(PO4)2
例:Na+ と SO42− → Na が 2 必要 → Na2SO4 - 多原子イオン(原子団)は 括弧でまとめ、括弧の外に個数を書く。
例:Cu(NO3)2、 Fe(OH)3、 (NH4)2CO3
読み方
基本は「陽イオン名 → 陰イオン名」の順で、和名(慣用名)がある場合は併記すると覚えやすい。
NaCl
塩化ナトリウム
MgCl2
塩化マグネシウム
Al2O3
酸化アルミニウム(コランダム)
CaCO3
炭酸カルシウム(石灰石・大理石・貝殻の主成分)
Ca3(PO4)2
リン酸カルシウム(ヒドロキシアパタイトの基本組成)
CuSO4 · 5H2O
硫酸銅(II)五水和物(和名:青礬)
※ 水和物は「・数字H2O」で表記。
例題
- Ba2+ と Cl− の組成式を書け。→ BaCl2
- Al3+ と SO42− の組成式を書け。→ Al2(SO4)3
- NH4+ と CO32− の組成式を書け。→ (NH4)2CO3
授業では、実際に陽イオン・陰イオンの 電荷を足し合わせて 0 になることを一緒に確認すると定着します。
🔩 イオンの結合と性質の紙媒体資料
イオンの結合と性質の資料はこちら
イオンの結合と性質